| هرگاه هیدروژن به اتمی با الکترونگاتیوی زیاد مثل فلوئور ، اکسیژن یا نیتروژن متصل گردد، شرایطی برای بوجود آمدن نوع بسیاری مهمی جاذبه بین مولکولی مثبت ـ منفی که آن را پیوند هیدروژنی میگویند حاصل میشود. به عبارت دیگر ، اتم هیدروژن یک مولکول و زوج الکترون غیر مشترک مولکول دیگر متقابلا همدیگر را جذب میکنند و پیوندی تشکیل میشود که به پیوند هیدروژنی ، Hydrogen Bond مرسوم است. |
اطلاعات اولیه
جاذبه بین مولکولی دربرخی از
ترکیبات هیدروژندار بطور غیرعادی قوی است. این جاذبه در ترکیباتی مشاهده میشود که درآنها بین هیدروژن و
عناصری که اندازه کوچک و
الکترونگاتیویته زیاد دارند، پیوند هیدروژنی وجود دارد. پیوند هیدروژنی نه تنها بین مولکولهای یک نوع ماده ، بلکه بین مولکولهای دو ماده متفاوت که توانایی تشکیل پیوند هیدروژنی را دارند نیز برقرار میشود.
نحوه تشکیل پیوند هیدروژنی
پیوند هیدروژنی بر اثر جاذبه اتم هیدروژن اندک مثبت موجود در یک مولکول و اتم بسیار الکترونگاتیو
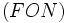
موجود در مولکول دیگر (یا در محل دیگر همان مولکول اگر مولکول به قدر کافی بزرگ باشد که بتواند روی خود خم شود) تولید میگردد. جا به جا شدن یک
جفت الکترون به سمت عنصر بسیار الکترونگاتیو نیتروژن ، اکسیژن یا فلوئور موجب میشود که این اتمها دارای بار منفی جزئی شوند.
در این صورت پیوند هیدروژنی پلی است میان دو
اتم شدیدا الکترونگاتیو با یک اتم هیدروژن که از طرفی بطور
کووالانسی با یکی از اتمهای الکترونگاتیو و از طرف دیگر بطور
الکترواستاتیکی (جاذبه مثبت به منفی) با اتم الکترونگاتیو دیگر پیوند یافته است. استحکام پیوند هیدروژنی
یکدهم تا
یکپنجاهم قدرت یک
پیوند کوالانسی متوسط است.
شرایط تشکیل پیوند هیدروژنی
- بالا بودن الکترونگاتیوی اتمهای متصل به هیدروژن: برهمین اساس است که فلوئور (الکترونگاتیوترین عنصر) ، قویترین پیوند هیدروژنی و اکسیژن (الکترونگاتیوتر از نیتروژن) ، پیوند هیدروژنی قویتری درمقایسه با نیتروژن تشکیل میدهد. همچنین بار مثبت زیاد بر روی اتم هیدروژن ، زوج الکترون مولکول دیگر را بشدت جذب میکند و کوچک بودن اندازه اتم هیدروژن سبب میشود که ملکول دوم بتواند به آن نزدیک شود.
- کوچک بودن اتمهای متصل به هیدروژن : پیوند هیدروژنی واقعا مؤثر فقط در ترکیبات فلوئور ، اکسیژن و نیتروژن تشکیل میشود. با وجود اینکه دو اتم نیتروژن و کلر ، الکترونگاتیوی برابر دارند، چون اتم کلر از اتم نیتروژن بزرگتر است بر خلاف نیتروژن ، کلر پیوند هیدروژنی ضعیفی تشکیل میدهد.
توجیه خواص غیرعادی برخی از مواد
وجود خواص غیرعادی برخی از مواد در حالت
جامد یا
مایع از جمله بالا بودن دماهای ذوب و جوش ، نشان میدهد که نیروهای جاذبه بین مولکولی در آنها به اندازهای زیاد است که نمیتوان آن را به تأثیرهای متقابل ضعیف بین مولکولی نسبت داد. آشناترین این نوع مواد ، فلوئورید هیدروژن ، آب و آمونیاک است که بسیاری از خواص آنها از جمله دماهای جوش و ذوب آنها از دماهای جوش و ذوب ترکیبهای مشابه خود ، برای مثال
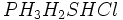
بطور غیرمنتظرهای بالاتر است.
شاید تصور شود که علت این وضعیت غیر عادی ، قطبیت به نسبت زیاد این مولکولهاست. البته تا اندازهای همین طور است. اما بررسی دقیق این پدیده غیر عادی نشان میدهد که باید نیروی جاذبه قویتر از نیروهای جاذبه دوقطبی _ دوقطبی بین مولکولهای آنها برقرار باشد.
اگر به ساختار الکترونی مولکولهای
توجه شود، میتوان به موردهای مشترک بین آنها پی برد. این وجه اشتراک ، وجود دست کم یک پیوند کوالانسی با اتم هیدروژن و یک
اوربیتال هیبریدی ناپیوندی دو الکترونی اتم مرکزی بسیار الکترونگاتیو در هر یک از آنهاست.
اتمهای
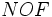
الکترونگاتیوی بالایی دارند با هیدروژن پیوند کوالانسی بشدت قطبی بوجود میآورند، بطوری که هیدروژن به میزان قابل توجهی خصلت یک
پروتون را پیدا میکند. جفت الکترون ناپیوندی و قابل واگذاری روی اتم الکترونگاتیو H ، این امکان را پدید میآورد که اتم هیدروژن در نقش پل ، اتمهای الکترونگاتیو دو
مولکول را به یکدیگر متصل کند و نیروی جاذبه بین مولکولی بوجود میآید که به پیوند هیدروژنی مرسوم است.
خواص ترکیبات دارای پیوند کووالانسی
ترکیباتی که مولکولهای آنها از طریق پیوند هیدروژنی به همدیگر پیوستهاند، علاوه بر دارا بودن
نقاط جوش بالا ، بطور غیرعادی در دمای بالا
ذوب میشوند و
آنتالپی تبخیر ،
آنتالپی ذوب و
گرانروی آنها زیاد است.
علت شناور بودن یخ
یخ روی آب شناور میماند، زیرا به هنگام
انجماد ، منبسط میشود. سبب این انبساط پیوند هیدروژنی میان مولکولهای خمیده آب است ساختار خمیده یا زاویهای مولکول آب ناشی از آرایش چهار وجهی چهار جفت الکترون در
لایه ظرفیت یک اتم است. ساختار زاویهای
مولکول آب و پیوند هیدروژنی میان مولکولهای آب به آن معنی است که هر مولکول آب میتواند حداکثر با چهار مولکول آب دیگر پیوند هیدروژنی داشته باشد.
پس آب مایع را میتوان به صورت خوشههایی از مولکولهای آب تصورکرد، خوشههایی که با پیوند هیدروژنی از مولکولهای آب ساخته شدهاند و دائم در حال حرکتند. شمار مولکولها در هر خوشه و سرعت حرکت خوشهها به
دما بستگی دارد. با سرد شدن آب ، مجموعههایی از مولکولهای آب که بسرعت در حرکتاند، کند میشوند و در نقطه انجماد به یکدیگر قلاب شده ساختمان سه بعدی منبسط شدهای را بوجود میآورند. این ساختمان گستردهتر موجب میشود که تراکم یخ کمتر از آب باشد.
ذوب شدن یخ در حدود 15% انرژی پیوندهای هیدروژنی را میشکند و این امر سبب فرو ریختن ساختار میشود. در نتیجه مایعی متراکم حاصل می گردد.
خاصیت عجیب دیگر آب ، نقطه جوش نسبتا زیاد آن است. تقریبا تمام ترکیبات هیدروژندار مجاور اکسیژن و اعضای خانواده آن یعنی
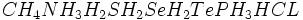
در دمای اتاق به حالت گازی هستند. اما آب مایع است. برای آنکه یک مولکول به حالت
بخار در آید، باید انرژی جذب کند تا بتواند خود را از قید مولکولهای دیگر آزاد کند. چون آب مایع با پیوند هیدروژنی به صورت خوشههایی از مولکولها در میآید، برای شکسته شدن پیوندهای هیدروژنی آن ، انرژی زیادی لازم است.
اما همه پیوندهای هیدروژنی شکسته نمیشوند و خوشههایی از مولکولهای آب حتی در نزدیکی 1000 درجه سانتیگراد هنوز وجود دارند. وقتی آب گرم میشود، آشفتگی گرمایی پیوند هیدروژنی را میگسلد تا آنکه در
بخار آب ، فقط جزء کوچکی از شمار پیوندهای هیدروژنی موجود در آب مایع یا جامد باقی میماند. اگر پیوند محکم میان مولکولی از قبیل پیوند هیدروژنی وجود نداشته باشد، مواد معمولا بنا به
جرم مولکولی خود به جوش میآیند.
جرمهای مولکولی بزرگتر برای جوش آمدن به دمای زیادتری نیازمندند. عمدتا به این دلیل که
ابرهای الکترونی بزرگتر آسانتر و پیچیده میشوند و این امر ، منجر به
نیروهای لاندن بین مولکولی قویتر میشود.
کاربردهای پیوند هیدروژنی
پیوندهای هیدروژنی در بسیاری از مواد یافت میشوند. پدیدههایی از قبیل چسبناک شدن آبنبات سفت ، دیرتر خشک شدن الیاف
پنبهای از الیاف
نایلونی ، نرم شدن
پوست با نایلون ، ناهنجارهای ظاهری در ماهیت آب ، همگی ناشی از همین پیوندهای هیدروژنی است.
پیوند هیدروژنی در تعیین ساختار و خواص مولکولهای سیستمهای زنده نقش اساسی دارد. اجزای مارپیچ آلفا در
ساختار پروتئینها و اجزای مارپیچ دوگانه در ساختار
DNA توسط پیوند هیدروژنی بهم میپیوندند. تشکیل و گسسته شدن پیوندهای هیدروژنی در تقسیم یافتن و
سنتز پروتئینها توسط آن دارای اهمیت اساسی است.
مباحث مرتبط با عنوان