حالت پیوندی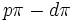
ساختار لوویس فسفریک اسید
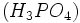
به صورت زیر است:
در این ساختار، تمام اتمها با قاعده هشتتایی هماهنگی دارند. اما میدانیم که در بسیاری از ترکیبات فسفر، اتم
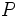
بیش از چهارپیوند کووالانسی تشکیل میدهد (مثلاً در
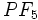
). چون اتم
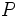
در پوسته والانس خود اوربیتالهای
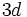
خالی دارد، محدودیت هشتتایی مربوط به چهارپیوند کووالانسی در مورد
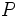
صادق نیست.
اگر در ساختار بالا، یک پیوند دوگانه وارد کنیم،
(وضعیت اتم
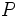
، دیگر با قاعده هشتتایی همخوانی ندارد (ساختار، روی اتم
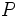
پنج پیوند کووالانسی نشان میدهد)، و بار قراردادی، حذف میشود.) در مثالهای پیشین، پیوند
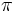
نتیجه همپوشانی دو اوربیتال
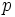
بود. در اینجا پیوند
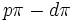
از همپوشانی یک اوربیتال
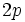
پر شده اتم
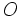
با یک اوربیتال
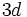
خالی اتم
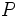
حاصل میشود. پیوندی به این صورت، گاهی حالت پیوندی
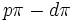
نامیده میشود.
شواهدی برای تایید وجود پیوند دوگانه در ساختار فسفریک اسید در دست است.طول پیوند
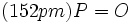
از طول سه پیوند
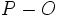
دیگر
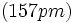
کمتر است.
اگر شعاعهای اتمی
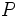
و
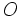
را به هم بیفزاییم، طول پیوند محاسبه شده برای
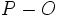
،
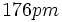
خواهد بود. بنابراین به نظر میرسد که حتی پیوندهای
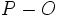
که در ساختار به صورت پیوند ساده نشان داده شدهاند، کوتاهتر از مقدار محاسبه شدهاند. کوتاه بودن غیرعادی پیوندها، قابل توجیه است. اگر بر هم کنش
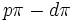
(که پیوند برگشتی نیز خوانده میشود) بین اتم
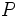
و تمام اتمهای
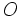
در پیوندهای
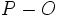
، تا حدی صورت گیرد که با هیچ یک پیوند
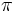
کامل به وجود نیاید. یون فسفات گاهی به صورت زیر نشان داده میشود:
خطوط بریده، نشانه بر هم کنش
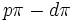
است. در این ساختار طول تمام پیوندهای
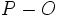
،
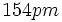
است.
ساختار لوویس و پیوندهای دو گانه سولفوریک اسید،
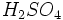
، عبارتاند از:
طول پیوندهای
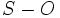
، در مولکول،
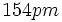
(برای پیوندهایی که به صورت ساده نشان داده شدهاند) و
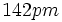
(برای پیوندهایی که به صورت پیوند دو گانه نشان داده شدهاند) است. اما طول پیوند ساده
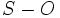
، بر مبنای به هم افزودن شعاع اتمی
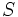
و
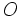
،
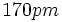
است که از هر دو طول پیوند مشاهده شده طولانیتر است. برهم کنش
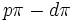
در همه پیوندهای
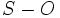
، سبب کوتاه شدن پیوندهای مزبور است. در یون سولفات:
تمام پیوندهای
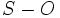
هم ارز هستند، طول پیوند
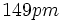
نشانه خصلت پیوندی
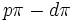
، در این پیوندهاست.
ساختار لوئیس پرکلریک اسید به صورت زیر است. در این ساختار با قراردادی بزرگی بر روی اتم کلر متمرکز است که موجب ناپایداری آن میشود:
هر عاملی که موجب کاهش بار مثبت اتم مرکزی شود مولکول را پایدار میکند. تشکیل پیوند بین جفت الکترون غیرپیوندی
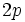
اکسیژن با اوربیتال خالی
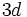
کلر موجب کاهش بار قرار دادی بر روی اتم مرکزی میشود. با تشکیل
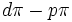
سه پیوند
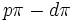
در پرکلریک اسید بار قراردادی کلر صفر میشود. چون کلر در این حالت از اوربیتالهای
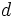
خود برای تشکیل پیوند استفاده میکند بنابراین بدیهی است که از قاعده هشتایی لوئیس تبعیت نمیکند. در اثر گرفتن پروتون از پرکلریک اسید با ایجاد چهار ساختار رزونانسی با انرژی یکسان، طول و انرژی تمام پیوندهای
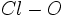
یکسان میشوند . طول پیوند
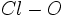
در یون پرکلرات
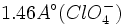
است، در حالی که طول پیوند دوگانه
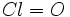
،
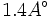
و طول پیوند ساده
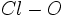
،
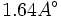
میباشد.
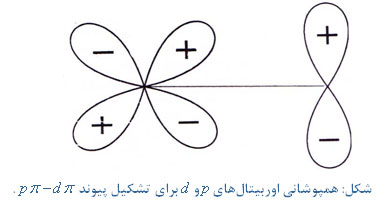
در شکل زیر آرایش فضایی مناسب اوربیتالهای
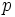
و
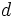
برای تشکیل پیوند
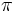
نشان داده شده است.
همچنین پیوند
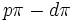
دانسیته الکترونی پیوندی را افزایش میدهد در نتیجه موجب افزایش زاویه پیوندی میشود برای مثال زاویه پیوندی درمولکولهای
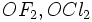
به ترتیب برابر با
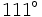
و
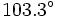
است که زاویه پیوندی بزرگتر در
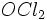
ناشی از وجود پیوند
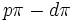
بین اکسیژن و کلر میباشد. امکان تشکیل پیوند
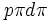
بین دو عنصر اکسیژن و فلوئور که از عناصر دوره دوم جدول تناوبی هستند، وجود ندارد.
به علاوه در مواردی که اکسیژن، فلوئور و نیتروژن که حداقل یک جفت الکترون غیرپیوندی دارند به یکی از عناصر دوره سوم مانند سیلسیم، فسفر، گوگرد و کلر متصل شوند، پیوند
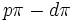
تشکیل میشود چون در این حالت پیوند
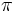
بین دو اوربیتال
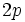
و
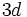
تشکیل میشود که انرژی آنها تا حدی به هم نزدیک است. قدرت پیوند
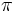
نسبتاً قوی است. این پیوند با عناصر دورههای بالاتر نیز تشکیل میشود ولی به علت اختلاف انرژی زیاد بین
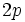
با اوربیتالهای
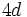
و
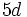
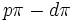
در این موارد ضعیفتر است.
همچنین، چون نافلزات تناوب دوم، در پوسته والانس خود، اوربیتال
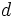
ندارند، حالت پیوندی
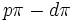
در ترکیباتی که اتم مرکزیشان از عناصر تناوب دوم است دیده نمیشود. چنین ترکیباتی (مثل
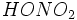
)، میتوانند پیوندهای دو گانه داشته باشند، ولی این پیوندها توسط اوربیتالهای
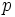
، به وجود میآیند.
پس به طور کلی برای توصیف اسیدهای دوره سوم میتوان از ساختار لوویس یا نمایش پیوند دوگانه استفاده کرد. اگر ساختار لوویس به کار برده میشود، کوتاه بودن پیوندها را میتوان براساس جاذبه بارهای مثبت و منفی قراردادی، روی اتمهای ترکیب توجیه کرد. صرفنظر از آنکه کدام روش برای توصیف مولکول مورد استفاده قرار گیرد، استفاده از مفهوم برهمکنش
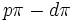
حتی برای پیوندهای ساده، برای توجیه کوتاه بودن پیوندها در مولکول این اسیدها، ضروری است.
پیوند های خارجی
http://Olympiad.roshd.ir/chemistry/content/pdf/0314.pdf


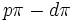
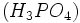 به صورت زیر است:
به صورت زیر است: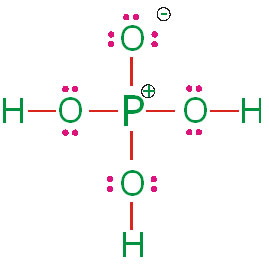
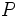 بیش از چهارپیوند کووالانسی تشکیل میدهد (مثلاً در
بیش از چهارپیوند کووالانسی تشکیل میدهد (مثلاً در 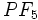 ). چون اتم
). چون اتم 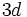 خالی دارد، محدودیت هشتتایی مربوط به چهارپیوند کووالانسی در مورد
خالی دارد، محدودیت هشتتایی مربوط به چهارپیوند کووالانسی در مورد 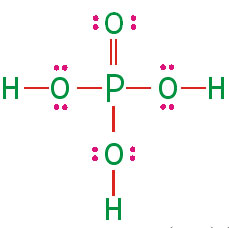
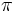 نتیجه همپوشانی دو اوربیتال
نتیجه همپوشانی دو اوربیتال 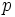 بود. در اینجا پیوند
بود. در اینجا پیوند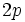 پر شده اتم
پر شده اتم 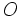 با یک اوربیتال
با یک اوربیتال 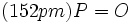 از طول سه پیوند
از طول سه پیوند 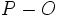 دیگر
دیگر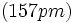 کمتر است.
کمتر است.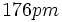 خواهد بود. بنابراین به نظر میرسد که حتی پیوندهای
خواهد بود. بنابراین به نظر میرسد که حتی پیوندهای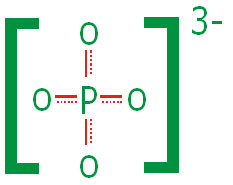
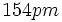 است.
است.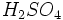 ، عبارتاند از:
، عبارتاند از: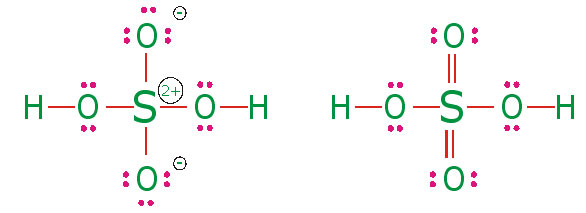
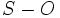 ، در مولکول،
، در مولکول، 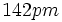 (برای پیوندهایی که به صورت پیوند دو گانه نشان داده شدهاند) است. اما طول پیوند ساده
(برای پیوندهایی که به صورت پیوند دو گانه نشان داده شدهاند) است. اما طول پیوند ساده 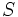 و
و 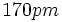 است که از هر دو طول پیوند مشاهده شده طولانیتر است. برهم کنش
است که از هر دو طول پیوند مشاهده شده طولانیتر است. برهم کنش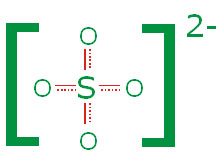
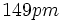 نشانه خصلت پیوندی
نشانه خصلت پیوندی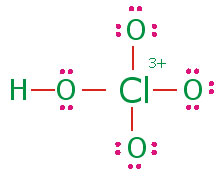
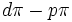 سه پیوند
سه پیوند 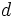 خود برای تشکیل پیوند استفاده میکند بنابراین بدیهی است که از قاعده هشتایی لوئیس تبعیت نمیکند. در اثر گرفتن پروتون از پرکلریک اسید با ایجاد چهار ساختار رزونانسی با انرژی یکسان، طول و انرژی تمام پیوندهای
خود برای تشکیل پیوند استفاده میکند بنابراین بدیهی است که از قاعده هشتایی لوئیس تبعیت نمیکند. در اثر گرفتن پروتون از پرکلریک اسید با ایجاد چهار ساختار رزونانسی با انرژی یکسان، طول و انرژی تمام پیوندهای 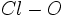 یکسان میشوند . طول پیوند
یکسان میشوند . طول پیوند 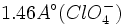 است، در حالی که طول پیوند دوگانه
است، در حالی که طول پیوند دوگانه 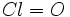 ،
،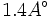 و طول پیوند ساده
و طول پیوند ساده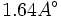 میباشد.
میباشد.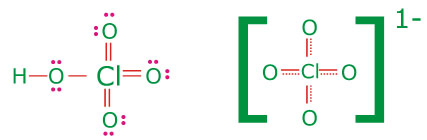
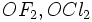 به ترتیب برابر با
به ترتیب برابر با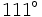 و
و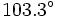 است که زاویه پیوندی بزرگتر در
است که زاویه پیوندی بزرگتر در 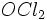 ناشی از وجود پیوند
ناشی از وجود پیوند 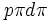 بین دو عنصر اکسیژن و فلوئور که از عناصر دوره دوم جدول تناوبی هستند، وجود ندارد.
بین دو عنصر اکسیژن و فلوئور که از عناصر دوره دوم جدول تناوبی هستند، وجود ندارد.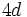 و
و 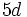
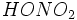 )، میتوانند پیوندهای دو گانه داشته باشند، ولی این پیوندها توسط اوربیتالهای
)، میتوانند پیوندهای دو گانه داشته باشند، ولی این پیوندها توسط اوربیتالهای